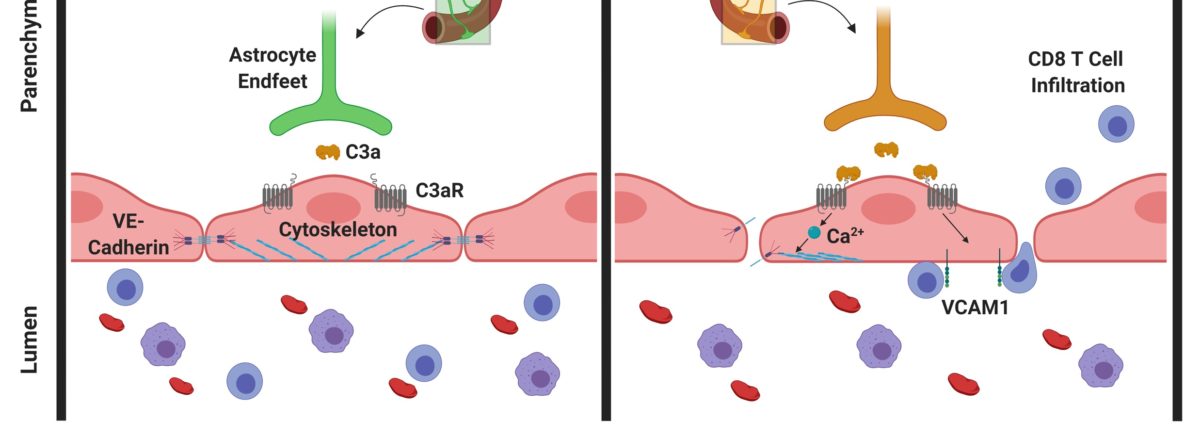
Im alternden Gehirn nimmt die C3/C3a-Produktion zu und die C3a-Rezeptoren auf Gefäßendothelzellen des Gehirns werden aktiviert. Als Reaktion darauf produzieren diese Zellen vermehrt das Adhäsionsmolekül VCAM‑1, was zu einer verstärkten Einwanderung von Lymphozyten in das Gehirn führt. Zusätzlich kommt es durch die Aktivierung des C3a-Rezeptors zu einer Mobilisierung von Calcium-Ionen in den Zellen, was zu einer Störung des Gefäßendothel-Cadherins führt, welches von zentraler Bedeutung für die Verbindung dieser Zellen ist. Ein Aufbrechen dieser Verbindungen hat eine erhöhte Durchlässigkeit der Blut-Hirn-Schranke zur Folge. Foto: Jörg Köhl, Uni Lübeck
Teil der Immunabwehr reguliert Blut-Hirn-Schranke
Wenn der Mensch älter wird, verändern sich Strukturen und Funktionen im Gehirn. Eine wichtige altersabhängige Veränderung ist die erhöhte Durchlässigkeit der Blut-Hirn-Schranke, die normalerweise nur bestimmte Stoffe aus der Blutbahn in das Gehirn hinein und wieder hinauslässt. Dies kann unter anderem die Entstehung von neurodegenerativen Erkrankungen wie Alzheimerdemenz begünstigen.
Eine Reihe von vorangegangenen Studien legt nahe, dass die verminderte Funktion der Blut-Hirn-Schranke mit immunologisch-bedingten Entzündungsprozessen zusammenhängt – die genauen Mechanismen dahinter sind jedoch bisher wenig verstanden. In Laborversuchen hat jetzt Professor Jörg Köhl, Direktor des Instituts für Systemische Entzündungsforschung Lübeck (ISEF), zusammen mit der Arbeitsgruppe von Professor Hui Zheng (Huffington Center on Aging, Houston, USA) einen Mechanismus identifiziert, durch den das sogenannte Komplementsystem, ein bestimmter Teil des Immunsystems, die Gefäßentzündung und die damit assoziierte gestörte Funktion der Blut-Hirn-Schranke während des Alterungsprozesses reguliert. Ihre Ergebnisse haben die Forschenden vor kurzem in der Fachzeitschrift »Journal of Clinical Investigation« veröffentlicht.
Das Komplementsystem ist Teil der angeborenen Immunabwehr. Es besteht aus mehr als 40 Proteinen, die im Blut und als Rezeptoren auf der Oberfläche von Zellen vorkommen. Zu diesen Proteinen gehören die sogenannten Komplementfaktoren und deren Spaltprodukte, sowie Rezeptoren, die diese Spaltprodukte erkennen.
Das System spielt eine wichtige Rolle bei der Abwehr von Mikroorganismen. Es signalisiert die Anwesenheit von Krankheitserregern sowie die Bindung von Antikörpern an Krankheitserreger, aber auch an körpereigene Strukturen. Durch Fehlregulation des Komplementsystems kann es jedoch auch im Verlauf von bestimmen Erkrankungen zu einer überschießenden Entzündungsreaktion kommen, die Gewebeschäden verursacht. Während die meisten Komplementproteine in der Leber produziert werden, ist seit längerem bekannt, dass sowohl Komplementfaktoren als auch Komplementrezeptoren davon unabhängig auch direkt im Gehirn produziert werden. Von besonderer Bedeutung ist der Komplementfaktor C3, der in zwei Teile gespalten werden kann, C3b und C3a. C3a löst seine biologische Wirkung dadurch aus, dass es an den C3a-Rezeptor bindet, der u.a. auf Gefäßendothelzellen, also den Zellen, die das Innere von Blutgefäßen auskleiden, und verschiedenen Gehirnzellen vorhanden ist.
In der jetzt publizierten Studie konnten die Forschenden zeigen, dass im alternden Gehirn die C3/C3a-Produktion zunimmt und es zu einer Aktivierung des C3a-Rezeptors auf Gefäßendothelzellen des Gehirns kommt. Als Reaktion darauf produzieren diese Zellen vermehrt ein bestimmtes Adhäsionsmolekül, was zu einer verstärkten Einwanderung von Lymphozyten, also speziellen Immunzellen, in das Gehirn führt. Zusätzlich induziert die Aktivierung des C3a-Rezeptors auf den Gefäßendothelzellen die Freisetzung von intrazellulären Calcium-Ionen. Das führt zu einer Störung eines speziellen Proteins auf den Gefäßendothelzellen, welches von zentraler Bedeutung für die Verbindung dieser Zellen ist. Ein Aufbrechen dieser Verbindungen hat eine erhöhte Durchlässigkeit der Blut-Hirn-Schranke zur Folge. Dadurch ist das Gehirn nicht mehr so gut vom Rest des Körpers abgegrenzt, so dass Entzündungen aus der Umgebung leichter auch auf das Gehirn übergreifen können.
Um diesen Krankheitsmechanismus aufzuklären, hatten die Forschenden einen transgenen Mausstamm entwickelt, bei dem die Mäuse genetisch so verändert sind, dass sie keinen C3a-Rezeptor auf den Gefäßendothelzellen mehr ausbilden. Die spezifische Ausschaltung des C3a-Rezeptors in den Gefäßendothelzellen schützte die Mäuse nicht nur vor einer erhöhten Durchlässigkeit der Blut-Hirn-Schranke im Alter. Sie reduzierte zudem die entzündliche Aktivität von speziellen Immunzellen im Gehirn, den Mikrogliazellen, und vergrößerte das Volumen des Hippocampus und der Großhirnrinde von alternden Mäusen im Vergleich zu Tieren mit C3a-Rezeptor. Der Hippocampus ist von besonderer Bedeutung für Lern- und Gedächtnisprozesse.
»Unsere Befunde zeigen eine neue, durch das Komplementsystem gesteuerte Regulation der Blut-Hirn-Schranke auf und damit verbunden der Immunzellaktivierung, Entzündung und Degeneration im alternden Gehirn«, sagt Köhl. »Die Daten deuten darauf hin, dass die gezielte Blockierung einzelner Elemente des Komplementsystems zu einer wesentlichen Verbesserung der Gefäßfunktion und Verringerung der Durchlässigkeit der Blut-Hirn-Schranke führen könnte und damit zu einer Reduktion der Neuroinflammation sowie Neurodegeneration im Alter«, so Köhl weiter.
Die Beobachtungen könnten auch interessant sein im Hinblick auf akute Entzündungszustände wie Schlaganfälle und Schädel-Hirn-Traumata oder neurodegenerative Erkrankungen, insbesondere Alzheimer, bei denen das Alter der größte Risikofaktor ist. »Aus vorangegangenen Studien ist bekannt, dass das Komplementsystem auch bei diesen Erkrankungen stark aktiviert wird«, erklärt Köhl. »Unsere Erkenntnisse könnten also zukünftig auch neue Therapieansätze für diese altersbedingten Erkrankungen des Gehirns ermöglichen.«
Originalpublikation:
Propson N.E., Roy E.R. Litvinchuk A., Köhl J., Zheng H.: Endothelial C3a receptor mediates vascular inflammation and BBB permeability during aging. J.Clin. Invest. (2020); first published Sep 29, 2020. DOI: 10.1172/JCI140966
Textquelle: Frederike Buhse, Exzellenzcluster Präzisionsmedizin für chronische Entzündungserkrankungen
Bildquelle: Im alternden Gehirn nimmt die C3/C3a-Produktion zu und die C3a-Rezeptoren auf Gefäßendothelzellen des Gehirns werden aktiviert. Als Reaktion darauf produzieren diese Zellen vermehrt das Adhäsionsmolekül VCAM‑1, was zu einer verstärkten Einwanderung von Lymphozyten in das Gehirn führt. Zusätzlich kommt es durch die Aktivierung des C3a-Rezeptors zu einer Mobilisierung von Calcium-Ionen in den Zellen, was zu einer Störung des Gefäßendothel-Cadherins führt, welches von zentraler Bedeutung für die Verbindung dieser Zellen ist. Ein Aufbrechen dieser Verbindungen hat eine erhöhte Durchlässigkeit der Blut-Hirn-Schranke zur Folge. Foto: Jörg Köhl, Uni Lübeck