Neuer Mechanismus der Krebsentstehung entdeckt
Das Harnblasenkarzinom ist eine häufige Krebsart in Deutschland und anderen Industrieländern. Für fortgeschrittene Tumore gibt es kaum wirksame Medikamente und auch frühzeitig chirurgisch entfernter Krebs kehrt oft an anderen Stellen der Harnblase wieder. Als molekulare Ursache von Blasenkrebs wurden kürzlich Mutationen im Erbgut entdeckt, die bestimmte Regulatorproteine inaktivieren, welche für die stabile Ausdifferenzierung der Zellen verantwortlich sind. Im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes haben Wissenschaftler des Universitätsklinikums Düsseldorf nun untersucht, wie die Inaktivierung solcher Proteine zur Bildung von Harnblasentumoren beiträgt.
Die Behandlung des in Deutschland und anderen Industrieländern häufig diagnostizierten Harnblasenkarzinoms wird dadurch erschwert, dass für fortgeschrittene Tumore kaum wirksame Medikamente zur Verfügung stehen und selbst Tumore früher Stadien zwar chirurgisch entfernt werden können, jedoch sehr häufig an anderen Stellen der Harnblase wiederkehren. Ursächlich für die Entstehung des Harnblasenkarzinoms sind schon länger bekannte Störungen in verschiedenen zellulären Kontrollsystemen, besonders in der Regulation des Zellzyklus. Bei der systematischen Untersuchung der genetischen Veränderungen in den letzten Jahren wurde zudem beobachtet, dass fast alle Harnblasenkarzinome Mutationen aufweisen, die epigenetische Regulatorproteine inaktivieren, am häufigsten die Proteine UTX und MLL2. Allgemein ermöglichen epigenetische Regulationsprozesse die Entstehung von ganz unterschiedlichen Zellarten, beispielsweise Leber- oder Harnblasenzellen, obwohl deren Erbgut identisch ist. Speziell die beiden epigenetischen Regulatoren UTX und MLL2 wirken gewöhnlich zusammen, um bei der Differenzierung von Zellen aus Stammzellen den neuen Aktivitätszustand des Genoms stabil einzustellen.
Wie die Inaktivierung solcher Regulatorproteine zur Bildung von Harnblasenkarzinomen beiträgt, war bislang jedoch unbekannt.
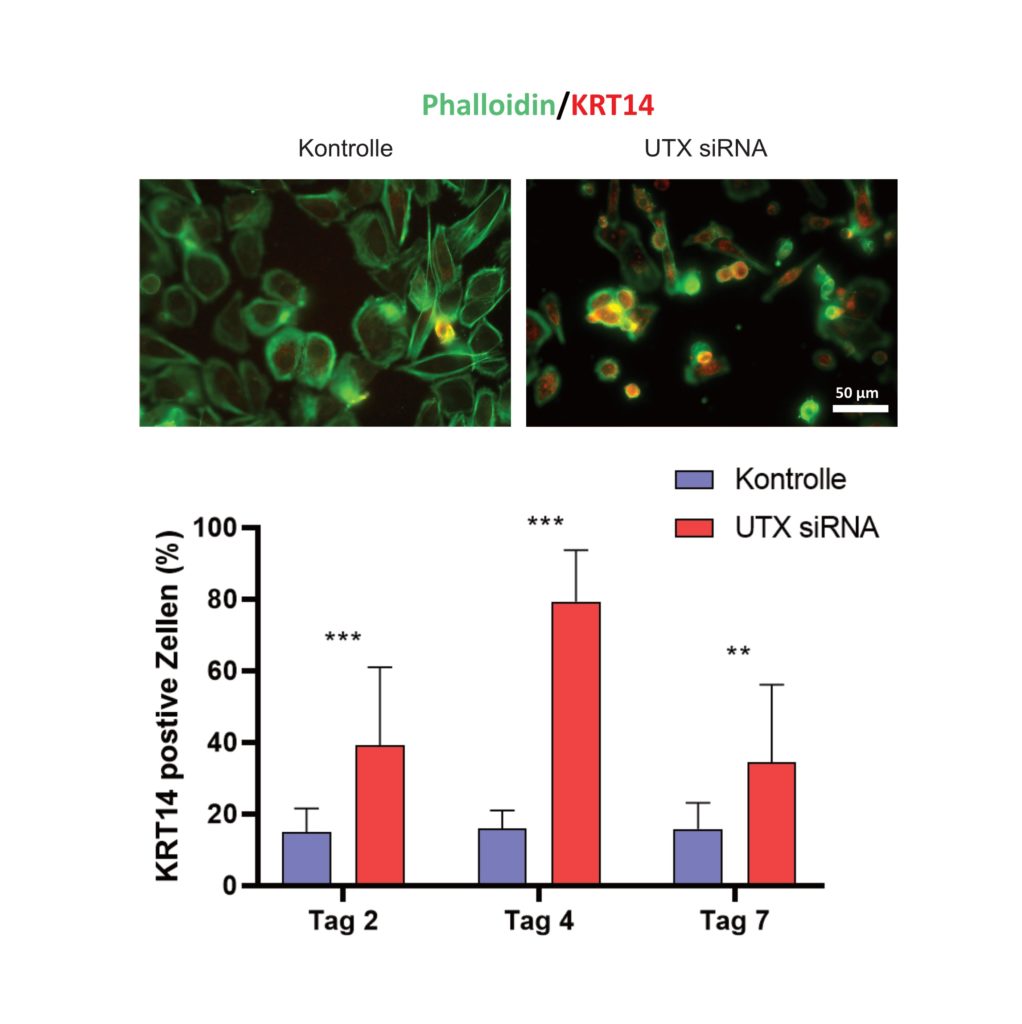
In einem von der Wilhelm Sander-Stiftung geförderten Forschungsprojekt hat die Arbeitsgruppe um Prof. Dr. rer. nat. Wolfgang A. Schulz vom Forschungslabor Urologie der Urologischen Klinik am Universitätsklinikum Düsseldorf diese Frage nun am Beispiel des Regulatorproteins UTX untersucht. Die Wissenschaftler stellten zunächst fest, dass die Inaktivierung oder Wiedereinführung von UTX in etablierten Tumorzellen deren Vermehrung erstaunlich wenig beeinflusste. Dies führte sie zu der Annahme, dass die Inaktivierung von UTX vor allem in der Anfangsphase zur Tumorentstehung beitragen müsste. Daher untersuchten sie im zweiten Schritt die Auswirkungen der Inaktivierung von UTX in normalen Harnblasenzellen (Urothelzellen). Wie die Forscher nun in ihrer am 21. April 2020 erschienenen Publikation in der renommierten Fachzeitschrift Cancers (Lang et al. Cancers 12(4): 1023, 2020) detailliert zeigen konnten, führt diese Inaktivierung von UTX zum Untergang differenzierterer Urothelzellen und mithin zur Anreicherung von Stammzellen, die sich über den Stammzellmarker Zytokeratin 14 (KRT 14) spezifisch nachweisen lässt (siehe Abbildung).
Die Ergebnisse der Düsseldorfer Forscher legen ein neues Modell zur Entstehung von Harnblasenkarzinomen nahe. Demnach führt die Inaktivierung epigenetischer Regulatorproteine wie UTX zur Expansion von Stammzellen mit verändertem epigenetischem Zustand in der Harnblase. Kommen weitere genetischen Veränderungen hinzu – beispielsweise im Tumorsuppressor p53, der eine der wichtigsten Kontrollinstanzen für das Zellwachstum darstellt – können sich daraus Tumore entwickeln. Eine Expansion veränderter Stammzellen in der Harnblase würde insbesondere erklären, warum nach einer chirurgischen Entfernung immer wieder neue Tumoren an anderen Stellen auftreten.
Originalpublikation: Lang A, Whongsiri P, Yilmaz M, Lautwein T, Petzsch P, Greife A, Günes C, Köhrer K, Niegisch G, Hoffmann M, Schulz WA. Knockdown of UTX/KDM6A Enriches Precursor Cell Populations in Urothelial Cell Cultures and Cell Lines. Cancers (Basel). 2020 Apr 21;12(4). pii: E1023. doi: 10.3390/cancers12041023.
https://www.ncbi.nlm.nih.gov/pubmed/32326336
Textquelle: Henrike Boden, Wilhelm Sander-Stiftung
Bildquelle: (oben) Schematische Darstellung der Klassifikation der Tumorausdehnung beim Harnblasenkarzinom, Rechteinhaber: Der Reisende, wikipedia.com, Lizenz: CC BY-SA 3.0
