Forschungsteam der CAU entwickelt wenige Millimeter große Silikonstruktur zur kontrollierten Wirkstofffreisetzung. Größe und Aufbau können individuell bestimmt werden, je nach Art des Tumors. Foto: Florian Rasch
Gehirntumor: Nebenwirkungen bei Behandlung verringern
Glioblastome gehören zu den aggressivsten Gehirntumoren bei Erwachsenen. Durch ihr schnelles Wachstum und ihre Verschiedenartigkeit sind Glioblastome schwer zu behandeln. Operativ lassen sich die bösartigen Tumore in der Regel nicht vollständig oder dauerhaft entfernen. Im Anschluss folgt daher eine kombinierte Strahlen- und Chemotherapie, die allerdings mit Nebenwirkungen auf den gesamten menschlichen Körper verbunden sein kann. Als mögliche Alternative werden daher sogenannte lokale Therapieansätze erforscht. Diese wirken nicht systemisch, sondern setzen medizinische Wirkstoffe in geringer Konzentration gezielt dort frei, wo sie tatsächlich benötigt werden. Dies kann dabei helfen, den gesamten Körper zu entlasten und Nebenwirkungen zu reduzieren.
An solch schonenderen Therapien forschen Wissenschaftlerinnen und Wissenschaftler aus der Materialwissenschaft und der Medizin der Christian-Albrechts-Universität zu Kiel (CAU) und dem Universitätsklinikum Schleswig-Holstein (UKSH), Campus Kiel. Im Graduiertenkolleg 2154 »Materials for Brain« entwickeln sie gemeinsam neue Materialien für lokale Behandlungsstrategien bei chronischen Gehirnerkrankungen wie Epilepsie, Aneurysmen oder Tumore. Zur Behandlung von Glioblastomen stellten sie kürzlich einen Ansatz für eine besondere Silikonstruktur vor. Mit ihr könnten medizinische Wirkstoffe über einen langen Zeitraum kontrolliert an das Gehirn abgegeben und Tumore so schonender behandelt werden. Ihre Studie erschien im Journal ACS Biomaterials Science & Engineering und zusätzlich als Titelbild der Ausgabe.
Silikonstruktur gibt Wirkstoff über mehrere Tage ans Gehirn ab
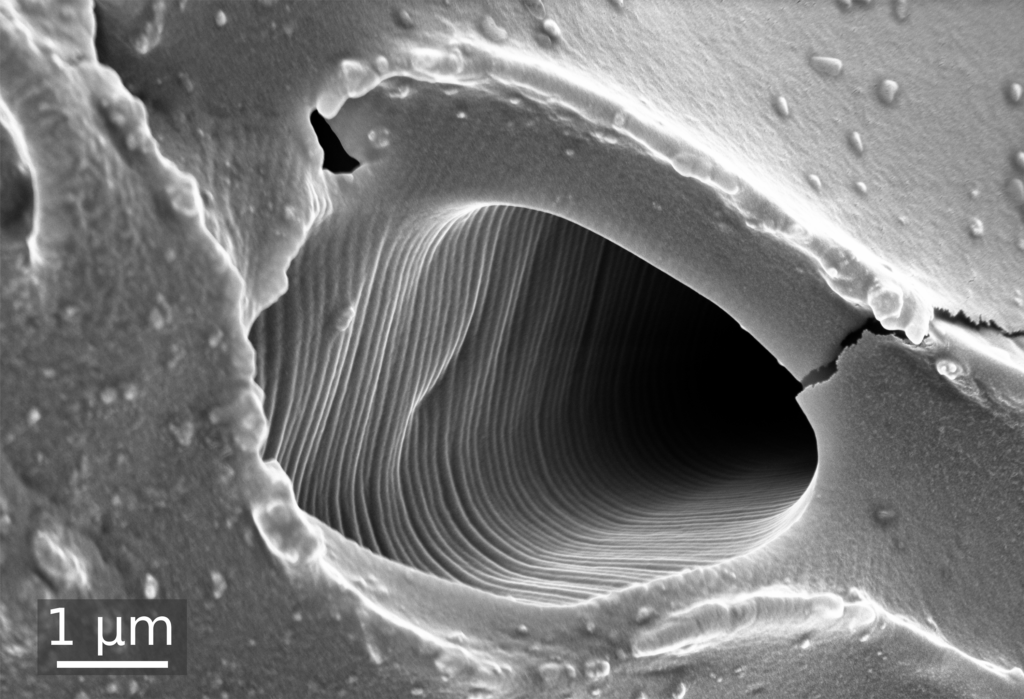
»Bisherige lokale Ansätze können große Mengen an Wirkstoff in kurzer Zeit freisetzen. Wir wollen Medikamente aber über eine längere Zeit kontinuierlich abgeben, um das Tumorwachstum länger zu hemmen«, erklärt Materialwissenschaftler Florian Rasch, einer der Erstautoren der Kieler Studie. In engem Austausch zwischen Materialwissenschaft und Medizin entwickelte das Forschungsteam eine spezielle, wenige Millimeter große Materialstruktur aus biokompatiblem Silikon, die medizinische Wirkstoffe abgeben kann. In das Material ätzten sie feine Tunnel mit einem Durchmesser von etwa zwei Mikrometern, was einem Zehntel eines menschlichen Haares entspricht. »Diese Tunnel bilden ein dicht verzweigtes Netzwerk, das wir mit unterschiedlichen Wirkstoffen befüllen können«, erläutert der Doktorand aus der Arbeitsgruppe »Funktionale Nanomaterialien«.
Im Anschluss an die operative Entfernung eines Glioblastoms wird das Material direkt im Gewebe des Gehirns platziert, so das Ziel des Forschungsteams. Dort soll der Wirkstoff langsam aus dem Tunnel-Netzwerk entweichen und vor Ort seine therapeutische Wirkung entfalten. »Je geringer die Anzahl der Tunnelöffnungen im Material und damit der Zugänge nach draußen, desto länger dauert es, bis der komplette Wirkstoff an das Gehirn abgegeben ist«, erklärt Christina Schmitt. Sie hat als Doktorandin am Anatomischen Institut Kiel an der Studie mitgewirkt und ihre Promotion im Bereich Life Sciences mittlerweile abgeschlossen.
Material lässt sich individuell an unterschiedliche Tumore und Therapien anpassen
In der Studie arbeitete das Team mit dem Wirkstoff AT101, der aus Baumwollpflanzen gewonnen wird und aufgrund seines tumorhemmenden Potentials für die Behandlung von Glioblastomen interessant ist. »Wir konnten zeigen, dass sich der Wirkstoff auf diese Weise über bis zu zehn Tage lang abgeben lässt. Prinzipiell sind sogar mehrere Wochen bis Monate denkbar«, sagt Vivian Adamski, mittlerweile promovierte Biochemikerin. Als Doktorandin an der Klinik für Neurochirurgie Kiel untersuchte Adamski für die Studie die Wirksamkeit des so freigesetzten Wirkstoffs in Krebszellen, Schmitt untersuchte die Auswirkungen auf gesunde Zellkulturen. Die Untersuchung erfolgte im Rahmen eines kombinatorischen Therapieansatzes bestehend aus dem Glioblastom-Standardtherapeutikum Temozolomid und dem aus dem Tunnelsystem freigesetzten Wirkstoff AT101. »Wir stellten deutliche wachstumshemmende und abtötende Effekte auf die Glioblastom-Zellen fest, während die gesunden Zellen weitestgehend unberührt blieben. Diese Ergebnisse sind vielversprechend für die weiteren Untersuchungen«, so Adamski weiter.
Die Wirkstoffabgabe können die Forschenden individuell an den jeweiligen Tumor und die benötigte Therapie anpassen, indem sie die Anzahl der Tunnel im Silikonmaterial variieren. Andere Ansätze mit ähnlichen Hohlröhren konnten bisher nur mit weitaus aufwendigeren Herstellungsverfahren in speziellen Reinraumumgebungen realisiert werden. Die technischen Anforderungen dort ließen jedoch kaum individuelle Anpassungen zu.
Interdisziplinäre Forschung an medizinisch komplexen Herausforderungen
Mit dieser zunächst rein mechanischen Modellstudie wollen die Kieler Forschenden die Wirkstoffabgabe möglichst realistisch simulieren, bevor sie ihre Silikonstruktur nun für die konkrete medizinische Anwendung weiterentwickeln und in Modellorganismen untersuchen. Langfristig hoffen sie, die Freisetzung von Medikamenten noch stärker beeinflussen zu können, zum Beispiel indem sie sie nach Bedarf von außen aktivieren oder deaktivieren.
»Die Erforschung solch komplexer medizinischer Herausforderungen lässt sich in Zukunft nur in enger fachübergreifender Zusammenarbeit vorantreiben. Das Graduiertenkolleg 2154 bietet dafür ideale Bedingungen und wir freuen uns, diese interdisziplinären Kompetenzen an hochkarätige Nachwuchsforschende aus dem In- und Ausland zu vermitteln«, sagt Professor Rainer Adelung, Leiter der Arbeitsgruppe »Funktionale Nanomaterialien« und Sprecher des Graduiertenkollegs.
Originalpublikation:
Macroscopic Silicone Microchannel Matrix for Tailored Drug Release and Localized Glioblastoma Therapy. Florian Rasch, Christina Schmitt, Lena M. Saure, Rieke Meyer, Vivian Adamski, Duygu Dengiz, Regina Scherließ, Ralph Lucius, Michael Synowitz, Yogendra K. Mishra, Kirsten Hattermann, Rainer Adelung, Janka Held-Feindt, and Fabian Schütt. ACS Biomaterials Science & Engineering 2020 6 (6), 3388–3397. DOI: 10.1021/acsbiomaterials.0c00094 https://pubs.acs.org/doi/10.1021/acsbiomaterials.0c00094
Textquelle: Dr. Boris Pawlowski, Christian-Albrechts-Universität zu Kiel
Bildquelle: (oben) Forschungsteam der CAU entwickelt wenige Millimeter große Silikonstruktur zur kontrollierten Wirkstofffreisetzung. Größe und Aufbau können individuell bestimmt werden, je nach Art des Tumors. Foto: Florian Rasch
Bildquelle: (unten) Eine der Tunnelröhren im Silikonmaterial in 12.000-facher Vergrößerung unter dem Rasterelektronenmikroskop. Abbildung: Florian Rasch

