Blick auf die Alte Universität Würzburg, Domerschulstraße. Foto: Robert Emmerich / Uni Würzburg
Gedächtnistraining für das Immunsystem
Nach einer Infektion merkt sich das Immunsystem den Krankheitserreger und kann deshalb bei einer erneuten Infektion schnell reagieren. Wissenschaftler der Universität Würzburg haben jetzt neue Details dieses Vorgangs entschlüsselt.
Wenn Krankheitserreger in den menschlichen Körper eindringen, setzt dies in der Regel eine Kaskade von Reaktionen in Gang. Unter anderem werden in den Lymphknoten spezifische Zellen des Immunsystems, sogenannte T‑Zellen aktiviert, die sich anschließend teilen und vermehren. Gleichzeitig entwickeln diese Zellen bestimmte Funktionen, die sie dazu in die Lage versetzen, andere Zellen, die beispielsweise von einem Virus befallen sind, zu zerstören. Zusätzlich produzieren sie spezielle Proteine – sogenannte Zytokine –, mit deren Hilfe sie die Vermehrung der Krankheitserreger stoppen können.
Das Immunsystem und seine Funktionsweise steht im Zentrum der Forschung von Professor Wolfgang Kastenmüller, Inhaber des Lehrstuhls für Systemimmunologie I an der Julius-Maximilians-Universität Würzburg (JMU). Gemeinsam mit Professor Georg Gasteiger, Inhaber des Lehrstuhls für Systemimmunologie II, leitet er die Max-Planck-Forschungsgruppe für Systemimmunologie. Forschungsschwerpunkt dort ist das Wechselspiel des Immunsystems mit dem Organismus, insbesondere die Interaktion verschiedener Zellen des Immunsystems in lokalen Netzwerken und mit Zellen anderer Organsysteme.
Publikation in Nature Immunology
Jetzt haben Kastenmüller und sein Team neue Details der Arbeitsweise des Immunsystems entschlüsselt, die von Bedeutung sind, damit sich der Körper an frühere Infektionen erinnern kann. Ihre Ergebnisse haben sie in der aktuellen Ausgabe der Fachzeitschrift Nature Immunology veröffentlicht. Diese könnten dazu beitragen, die Immuntherapie zur Behandlung von Tumorerkrankungen zu verbessern.
»Wenn sich der Körper erfolgreich gegen einen Krankheitserreger zur Wehr gesetzt und diesen eliminiert hat, sterben die meisten der zuvor expandierten T‑Zellen wieder ab, da sie nicht mehr benötigt werden«, erklärt Wolfgang Kastenmüller. Etwa fünf bis zehn Prozent dieser Zellen überleben aber und entwickeln sich zu einer dauerhaften »Gedächtnispopulation«, die vor zukünftigen Infektionen schützen kann.
Das immunologische Gedächtnis verbessert
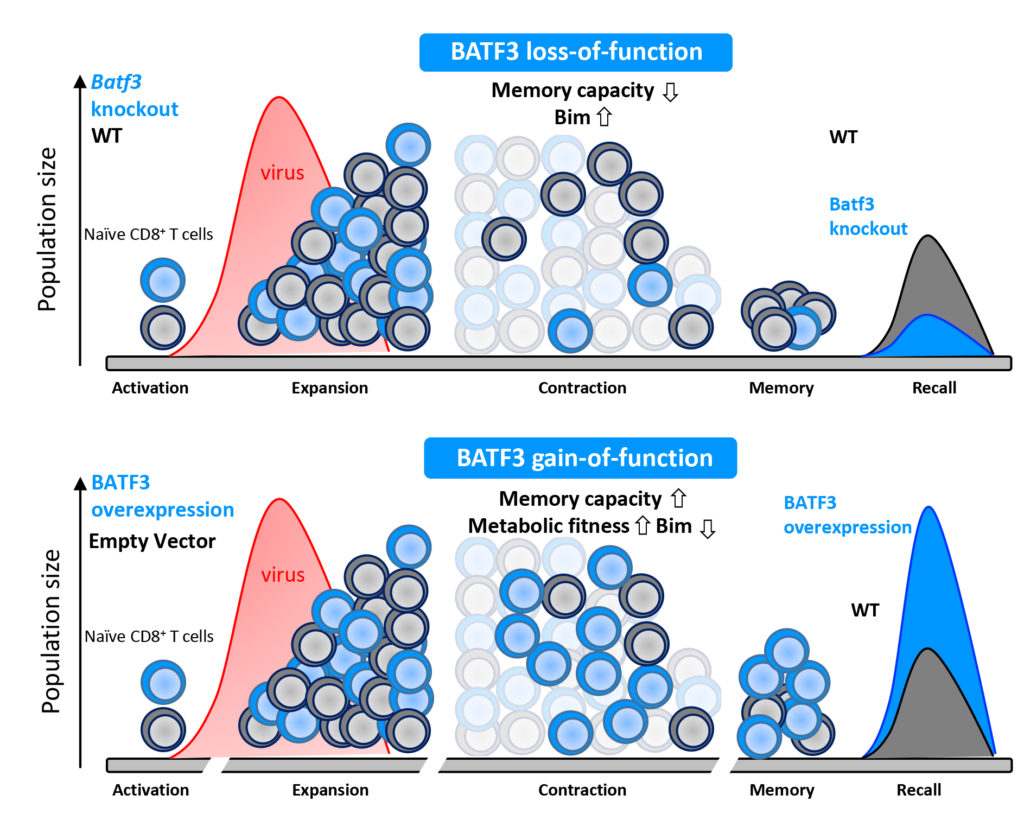
»In unserer aktuellen Arbeit haben wir einen Transkriptionsfaktor identifiziert, der spezifisch das Überleben dieser Zellen und damit den Übergang zu einer Gedächtnisantwort reguliert«, beschreibt Kastenmüller das zentrale Ergebnis der jetzt veröffentlichten Studie. Dessen Name: BATF3. Wie die Wissenschaftler in ihren Experimenten zeigen konnten, wird dieser Faktor nur kurz nach der anfänglichen Aktivierung der T‑Zellen produziert. Fehlt er hingegen, ist die Gedächtnisantwort dauerhaft gestört.
»Bisher war nicht klar, welche Rolle dieser Faktor für sogenannte CD8+ T‑Zellen spielt«, so Kastenmüller. Als die Forscher diesen Faktor jedoch verstärkt in CD8+ T‑Zellen exprimierten, zeigte sich, dass deren Überleben und entsprechend das immunologische Gedächtnis signifikant verbessert wurden.
Die neue Studie ist in enger Zusammenarbeit mit der Medizinischen Klinik II des Würzburger Universitätsklinikums entstanden. Sie kombiniert die Grundlagenforschung mit der angewandten Medizin und könnten dazu beitragen, bessere Therapien zur Behandlung von Krebs zu entwickeln, die dafür das Immunsystem der Erkrankten nutzen – sogenannte CAR-T-Zelltherapien.
Bei der CAR-T-Zelltherapie werden T‑Zellen aus dem Blut der Patienten extrahiert und genetisch mit Chimären-Antigenrezeptor-(CAR)-Molekülen umgebaut. Diese Veränderung versetzt die T‑Zellen in die Lage, Krebszellen anzugreifen, für die sie vorher biochemisch blind waren. Die umgebauten T‑Zellen werden dem Patienten anschließend wieder zugeführt. Aktuell werden CAR-T-Zellen zum Beispiel für die Therapie von B‑Zell-Lymphomen, einer bösartigen Erkrankung des lymphatischen Systems – sehr erfolgreich eingesetzt. Kastenmüller und sein Team planen jetzt in Kollaboration mit Professor Michael Hudecek, Medizinische Klinik II, diese CAR-T-Zellen zu modifizieren, um deren Überleben im Patienten zu verbessern und damit die therapeutische Effizienz zu erhöhen.
Originalpublikation:
»BATF3 programs CD8+ T cell memory«. Marco A. Ataide, Wolfgang Kastenmüller et al. Nature Immunology, 28. September 2020. DOI: 10.1038/s41590-020‑0786‑2. https://www.nature.com/articles/s41590-020‑0786‑2
Textquelle: Gunnar Bartsch, Julius-Maximilians-Universität Würzburg
Bildquelle: (oben) Blick auf das Alte Universitätsgebäude in Würzburg. Foto: Uni Würzburg
Grafikquelle: Schematische Darstellung der Funktion von BATF3. In der oberen Hälfte sind die physiologische Funktion und die Konsequenzen zu sehen, wenn dieser Faktor fehlt (knockout). Grafik: Dr. Marco Ataide

