Krebszellen, die im Gewebe der Bauchspeicheldrüse einen Klumpen bilden. Grafik: Scientific Animations Inc., Lizenz: CC BY-SA 4.0
Die Krebszellen in den Tod treiben
Er ist heimtückisch, aggressiv und nur selten zu besiegen: Der Bauchspeicheldrüsenkrebs gehört zu den tödlichsten Krebsarten in der westlichen Welt. Trotz der enormen Fortschritte der medizinischen Forschung weiß man noch immer nicht, wie Pankreaskarzinome genau entstehen und wie sie effektiv bekämpft werden können. Ulmer Wissenschaftlerinnen und Wissenschaftler haben nun in einer präklinischen Studie am Mausmodell gezeigt, wie sich bestimmte Krebszellen in den Tod treiben lassen. Sie haben dafür einen mutationsspezifischen kombinatorischen Therapieansatz gewählt, der sich gegen eine Karzinomvariante richtet, bei der ein wichtiges DNA-Reparaturgen (ATM) mutiert ist.
Den Forschenden gelang es durch die Kombination dreier Substanzen, die zellulären Reparaturmechanismen auf breiter Linie abzuschalten. Der Effekt: die Krebszellen starben ab und das Tumorwachstum wurde gehemmt. Veröffentlicht wurden die Ergebnisse der Studie in der renommierten britischen Fachzeitschrift »GUT«, sowie eine Erweiterung des Therapieregimes in »Cells«.
Bauchspeicheldrüsenkrebs ist nicht gleich Bauchspeicheldrüsenkrebs. Heute weiß man, dass unterschiedliche genetische Mutationen mit dieser Krebsart assoziiert sind. »Wir halten es für sehr sinnvoll, die Pankreaskarzinom-Patienten entsprechend ihrer Mutationen zu gruppieren, um die Erkrankung zielgerichtet behandeln zu können«, so der Studienleiter Professor Alexander Kleger vom Universitätsklinikum Ulm. Als Heisenberg Professor für Molekulare Onkologie leitet er eine Arbeitsgruppe zur Pankreasforschung. Der Mediziner ist Oberarzt und Leiter der Pankreatologie an der Klinik für Innere Medizin 1.
Bei einem Fünftel aller Patienten mit Pankreaskarzinom gibt es Mutationen in DNA-Reparaturgenen. Am häufigsten ist dabei das ATM-Gen betroffen. Dieses Gen kodiert für das Enzym ATM-Serin/Threonin-Kinase, das eine Schlüsselrolle bei der Reparatur von DNA-Doppelstrangbrüchen spielt. Ist dieses Gen mutiert, kann dieses Enzym nicht synthetisiert werden, sodass die Doppelstrangreparatur nicht mehr funktioniert. Um die DNA-Schäden zu beseitigen, treten alternative Reparaturmechanismen in Kraft, die jedoch weitaus fehleranfälliger sind. Für die Zellen bedeutet dies ein gewisses Reproduktionsrisiko, da die zelluläre Qualitätskontrolle bei der Zellteilung fehlerhafte »Kopiervorlagen« eliminiert und schadhafte Zellen in den Tod schickt.

Um Tumorzellen, die ATM-Mutationen aufweisen, selektiv abzutöten und dabei möglichst wenig Nebenwirkungen hervorzurufen, machen sich die Forscherinnen und Forscher diese besondere Tatsache zunutze: »Krebszellen mit Mutationen in solchen DNA-Reparaturgenen reagieren empfindlicher auf DNA-schädigende Medikamente als gesunde Körperzellen. Dadurch lässt sich die Spezifität des Zelltods auf Krebszellen besser konzentrieren«, erklären Dr. Lukas Perkhofer und Dr. Johann Gout. Der Oberarzt und der Postdoc aus der Klinik für Innere Medizin 1 teilen sich die Erstautorenschaft der Studie.
Um nicht nur die Reparatur von DNA-Doppelsträngen, sondern auch alternative Reparaturwege zu blockieren, hat das Forschungsteam drei unterschiedliche Medikamentengruppen kombiniert. Zu diesen gehören sogenannte PARP‑, ATR- und DNA-PK-Inhibitoren, die allesamt, aber auf unterschiedlichen Wegen hemmend in die genetische Schadensregulierung eingreifen. Unterbleibt die Reparatur massiver Genschäden, leitet die Zelle den gezielten Zelltod durch »Selbstmord« ein: die Apoptose. So wird der Tumor in seinem Wachstum gestoppt. Durch die Kombination dieser drei Komponenten sollen weniger Nebenwirkungen auftreten und Resistenzen so gut es geht vermieden werden. »Die gleichzeitige Hemmung der Kinase ATM durch spezifische Medikamente erlaubt eine potentielle Erweiterung der Therapie auf nicht ATM-mutierte Tumoren, gleichzeitig muss aber die Toxizität einer solchen potentiellen Therapie berücksichtigt werden« gibt der Studienleiter Kleger zu bedenken.
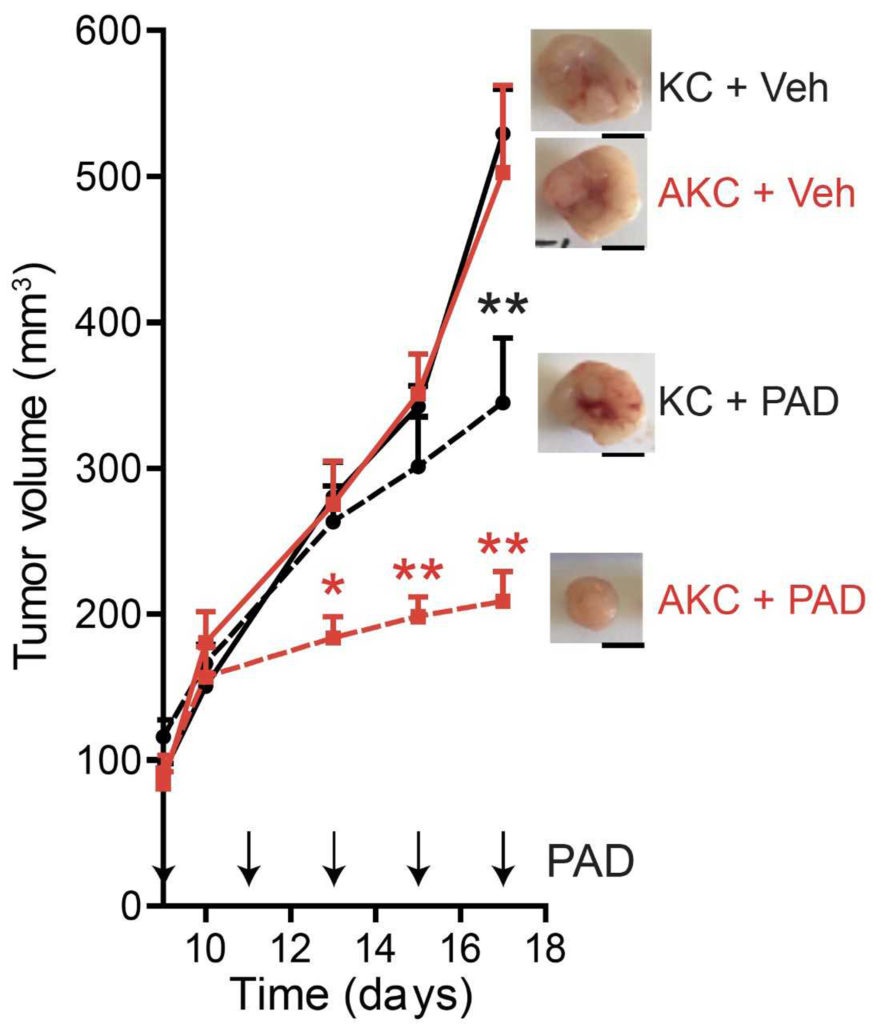
In dieser präklinischen Studie, an der weitere Wissenschaftlerinnen und Wissenschaftler aus Ulm sowie aus München und Mainz beteiligt waren, konnte dieser Effekt sowohl in der Zellkultur am Mausmodell gezeigt werden. Zum Einsatz kamen dabei sowohl murine als auch humane Pankreaskarzinomzellen. Mithilfe humaner Organoide, das heißt mit dreidimensionalen Zellkulturen, wurden die Ergebnisse validiert. »Die Studie hat gezeigt, dass unser mutationsspezifischer Kombinationsansatz sehr vielversprechend ist. Doch der Weg zur klinischen Krebstherapie ist noch weit«, sind sich die Forscher einig. Immerhin eröffnet die eingeschlagene Richtung neue Perspektiven für spezifischere und schonendere Behandlungsformen.
Originalpublikation:
Synergistic targeting and resistance to PARP inhibition in DNA damage repair-deficient pancreatic cancer. Lukas Perkhofer, Frank Arnold, Michaela Ihle, Stephanie Biber, Elodie Roger, Johann M Kraus, Katja Stifter, Stephan A Hahn, Andrea Zamperone, Thomas Engleitner, Martin Müller, Karolin Walter, Eva Rodriguez-Aznar, Bruno Sainz Jr, Patrick C Hermann, Elisabeth Hessmann, Sebastian Müller, Ninel Azoitei, André Lechel, Stefan Liebau, Martin Wagner, Diane M Simeone, Hans A Kestler, Thomas Seufferlein, Lisa Wiesmüller, Roland Rad, Pierre-Olivier Frappart, Alexander Kleger; in: GUT. 2020 Sep 1.
http://dx.doi.org/10.1136/gutjnl-2019–319970
Textquelle: Andrea Weber-Tuckermann, Universität Ulm
Bildquelle: Prof. Alexander Kleger (links), Dr. Lukas Perkhofer (Mitte), Dr. Johann Gout (rechts). Fotos (3): Uniklinikum Ulm
Bildquelle: Im Mausmodell sprechen jene Tumoren mit zusätzlichem ATM Verlust (AKC) signifikant besser auf die Therapiekombination mit PARP, ATR und DNA-PK Inhibition (PAD) an, als die allgemein verwendeten Kontrollen mit einfacher KRAS Mutation (KC). Grafik: Klinik für Innere Medizin 1, Uniklinikum Ulm
Bildquelle: (oben) Krebszellen, die im Gewebe der Bauchspeicheldrüse einen Klumpen bilden. Grafik: Scientific Animations Inc., Lizenz: CC BY-SA 4.0