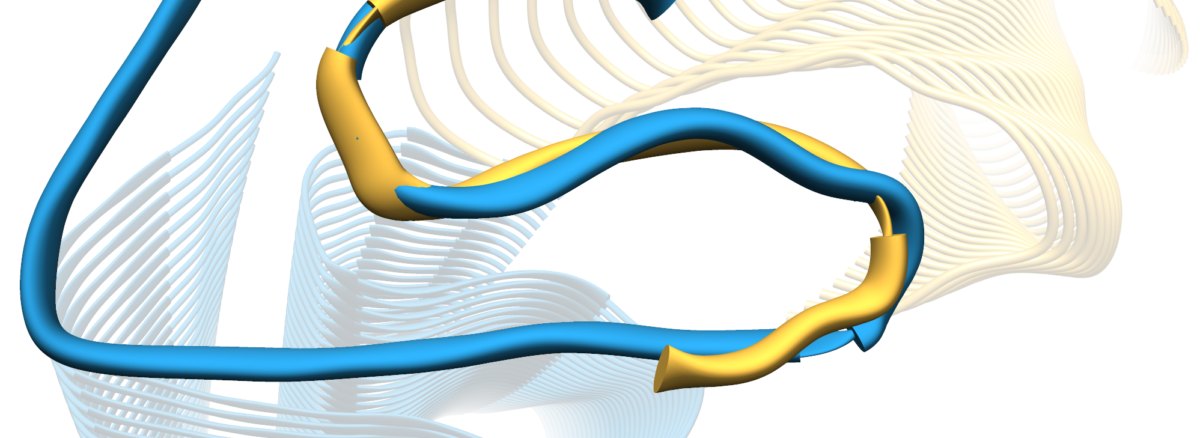
Foto: Querschnitte der 3D-Modelle der sogenannten Protofilamente von IAPP- und Aβ-Amyloidfibrillen. Die Überlagerung einzelner IAPP- und Aβ-Moleküle zeigt die Ähnlichkeit der S‑förmigen Faltungen. Bild: Gunnar Schröder
Zusammenhang zwischen Alzheimer und Diabetes?
Krankhaft verklumpte Eiweiße sind für eine ganze Reihe von Erkrankungen charakteristisch, unter anderem Alzheimer, Parkinson und der verbreitete Typ-2-Diabetes. Wissenschaftler des Forschungszentrums Jülich, der Heinrich-Heine-Universität Düsseldorf und der Universität Maastricht haben mittels Kryo-Elektronenmikroskopie nun erstmals ein scharfes Bild davon erhalten, wie sich einzelne Moleküle in den Proteinfäden anordnen, aus denen die Diabetes-typischen Ablagerungen bestehen. Die Struktur der Fasern in den sogenannten Fibrillen erinnert stark an die von Alzheimer-Fibrillen. Das Ergebnis steht im Einklang mit weiteren Gemeinsamkeiten, die Forscher in den letzten Jahren herausgefunden haben.
Bereits vor etwa 120 Jahren entdeckte der US-amerikanische Arzt Eugene Lindsay Opie in der Bauchspeicheldrüse von Patienten mit Typ-2-Diabetes auffällige Eiweißablagerungen, ähnlich wie sie auch im Gehirn bei zahlreichen neurodegenerativen Krankheiten zu finden sind. Typ-2-Diabetes ist eine der am weitesten verbreiteten Volkskrankheiten, und auch unter dem Begriff »Alterszucker« bekannt. Die Ablagerungen, genannt »Insel-Amyloid«, enthalten winzige Eiweißfäden. Diese werden auch als Fibrillen bezeichnet. Bei Diabetes bestehen sie aus dem Peptidhormon IAPP. In der Bauchspeicheldrüse tragen sie zum Absterben und zur Fehlfunktion der sogenannten Beta-Zellen bei, die für die Insulinproduktion zuständig sind. Das Hormon spielt bei der Senkung des Blutzuckers eine wichtige Rolle.
»Diese Amyloid-Fibrillen werden seit vielen Jahren intensiv erforscht. Lange Zeit konnte man aber nur auf sehr niedrig aufgelöste Strukturen zurückgreifen«, erklärt Gunnar Schröder vom Forschungszentrums Jülich und der Heinrich-Heine-Universität Düsseldorf. 2017 hat er gemeinsam mit Partnern und Kollegen eines der ersten atomgenauen 3D-Modelle einer solchen Fibrille überhaupt vorgestellt: in diesem Fall einer Alzheimer-Fibrille, die aus dem Peptid Amyloid-beta (Abeta) besteht.
»Nun haben wir zum ersten Mal eine IAPP-Fibrille, wie sie für Diabetes typisch ist, in vergleichbarer Auflösung in 3D rekonstruiert«, so Gunnar Schröder. Die erzielte Auflösung von 4 Angström, oder 0,4 Nanometer liegt in der Größenordnung von Atomradien und Atombindungslängen. Neben weiteren Details wird so erstmals die genaue Anordnung der Moleküle in den Fibrillen sichtbar. Das Modell zeigt, wie sich einzelne IAPP-Moleküle zu Fasern mit einem S‑förmigen Querschnitt übereinander schichten. Die Struktur ähnelt der S‑förmigen Faltung in Abeta-Fibrillen, die für Alzheimer typisch sind.

»Die Ähnlichkeit ist interessant. Zwischen Alzheimer und Diabetes gibt es einen epidemiologischen Zusammenhang: Alzheimer-Patienten haben ein größeres Risiko an Diabetes zu erkranken und umgekehrt«, erläutert Wolfgang Hoyer, der ebenfalls an der Heinrich-Heine-Universität Düsseldorf und am Forschungszentrum Jülich forscht. Daneben gibt es weitere Verbindungen. So haben Wissenschaftler in den Amyloid-Ablagerungen von Alzheimer-Patienten bereits kleine Beimischungen von »fremden« Diabetes-typischen IAPP-Peptiden nachgewiesen. Zudem wachsen nach Zugabe von Fibrillen der jeweils einen Art vermehrt auch Ablagerungen der anderen Art, wie Forscher in Versuchen mit Mäusen herausgefunden haben.
Mit dem neuen, hochaufgelösten Fibrillen-Modell gibt es nun eine neue Basis, um die Bildung der Fibrillen bei Diabetes besser zu verstehen und Medikamente zu entwickeln, die direkt an der Ursache der Erkrankung ansetzen. »Es lassen sich nun beispielsweise ganz gezielt Inhibitoren entwickeln, die die Ausbildung dieser Fibrillen unterdrücken«, erklärt Wolfgang Hoyer. Schon seit einigen Jahren forscht er an entsprechenden neuartigen Bindeproteinen. Diese verhindern, dass sich einzelne Moleküle zu Amyloid verbinden, und so möglicherweise den Ausbruch von Diabetes, Alzheimer und Parkinson verzögern oder sogar aufhalten können. Ein anderer Ansatz sei die Entwicklung von Ersatzstoffen für das Peptid IAPP, die nicht zur Fibrillenbildung neigen. IAPP übernimmt unter anderem die Funktion eines Sättigungshormons im Körper. Die Ersatzstoffe sind daher nicht nur für die Therapie von Typ-2-Diabetes, sondern auch zur Behandlung verschiedener weiterer Erkrankungen wie Typ-1-Diabetes und krankhafte Fettleibigkeit interessant.
Hintergrund Kryo-Elektronenmikroskopie
Die Kryo-Elektronenmikroskopie ist eine immer noch relativ junge Forschungsmethode zur atomgenauen Bestimmung der Struktur von Biomolekülen. Jacques Dubochet, Joachim Frank und Richard Henderson wurden 2017 für die Entwicklung des Verfahrens mit dem Chemie-Nobelpreis geehrt.
Die Methode erfüllt ähnliche Aufgaben wie die schon länger etablierten Verfahren der Röntgenkristallografie und der NMR-Spektroskopie. Bei der Röntgenkristallografie müssen Biomoleküle wie Proteine, die DNA oder Bakterien und Viren erst in Kristallform gebracht werden. Die Kryo-Elektronenmikroskopie und die NMR-Spektroskopie ermöglichen es dagegen, Eiweißbausteine in ihrer natürlichen Form im gelösten Zustand zu untersuchen. Im Falle der Kryo-Elektronenmikroskopie werden die in Wasser gelösten Proben schockgefroren und anschließend mit einem Elektronenmikroskop untersucht. Die Methode bietet insbesondere dann Vorteile, wenn es um die Erforschung größerer Strukturen aus Hunderten oder Tausenden Proteinen geht.
Originalpublikation: Cryo-EM structure of islet amyloid polypeptide fibrils reveals similarities with amyloid‑β fibrils / Christine Röder, Tatsiana Kupreichyk, Lothar Gremer, Luisa U. Schäfer, Karunakar R. Pothula, Raimond B. G. Ravelli, Dieter Willbold, Wolfgang Hoyer, Gunnar F. Schröder / Nature Structural & Molecular Biology (published online 15 June 2020), DOI: 10.1038/s41594-020‑0442‑4
Textquelle: Annette Stettien, Forschungszentrum Jülich