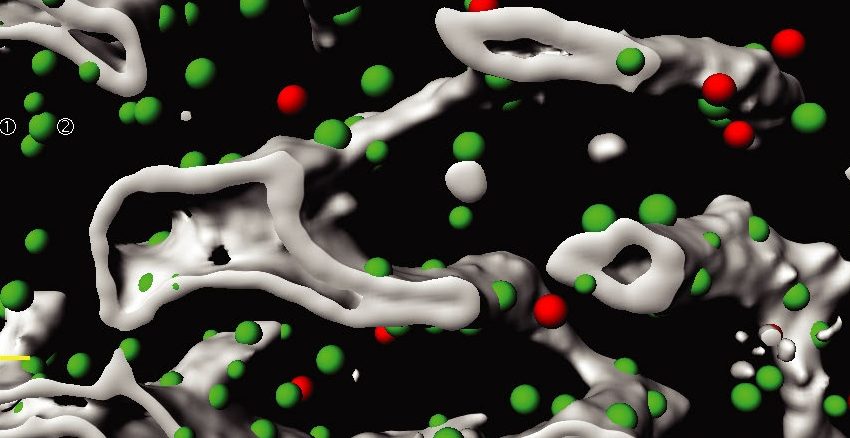
Stammzellen im Knochenmark erzeugen lebenslang alle Blut- und Immunzellen. Ein Heidelberger Forscherteam hat nun neue Methoden entwickelt, um die dreidimensionale Organisation des Knochenmarks auf Einzelzell-Ebene aufzuzeigen. Dabei haben die Wissenschaftler bislang unbekannte Zelltypen identifiziert, die eine spezifische Mikro-Umgebung schaffen, die für die Blutbildung aus Stammzellen erforderlich ist. Die aktuelle Arbeit zeigt die unerwartete Komplexität im Aufbau des Knochenmarks in einer beispiellosen Auflösung und liefert neue Möglichkeiten, Blutkrankheiten wie Leukämien zu untersuchen.
3D-Atlas des Knochenmarks
Mit ihrer Kombination neuer Methoden kann das Team vom Deutschen Krebsforschungszentrum (DKFZ), vom Heidelberger Institut für Stammzelltechnologie und Experimentelle Medizin (HI-STEM gGmbH) und vom Europäischen Laboratorium für Molekularbiologie (EMBL) grundsätzlich die Organisation aller komplexen Organe charakterisieren. In der aktuellen Arbeit konzentrierten sich die Forscher auf den Aufbau des Knochenmarks von Mäusen.
Bei allen Säugetieren beherbergt das Knochenmark die Blutstammzellen, die für die lebenslange Produktion der verschiedenen Blutzellen verantwortlich sind. Immer deutlicher zeigt sich, dass das Knochenmark die Fähigkeit hat, Stammzellen zu beeinflussen und damit die Blutbildung zu kontrollieren. Daher interessieren sich Wissenschaftler zunehmend für das Knochenmark in seiner Eigenschaft als „Nische“ der Blutstammzellen in der Hoffnung, dieses Wissen einmal für die Untersuchung und möglicherweise bessere Behandlung von Leukämie nutzen zu können.
„Bisher war nur sehr wenig darüber bekannt, wie die verschiedenen Zellen im Knochenmark organisiert sind und wie sie zur Erhaltung von Blutstammzellen interagieren“, erklärt Chiara Baccin aus der Gruppe von Lars Steinmetz am EMBL. „Unser Ansatz enthüllt die zelluläre Zusammensetzung, die dreidimensionale Organisation und die interzelluläre Kommunikation im Knochenmark. Dieses Gewebe war bisher mit herkömmlichen Methoden nur schwer zu untersuchen“, sagt Jude Al-Sabah aus der Forschungsgruppe von Simon Haas, DKFZ und HI-STEM.
Um zu verstehen, welche Zellentypen das Knochenmark zusammensetzen, wo sie lokalisiert sind und wie sie sich auf Stammzellen auswirken könnten, kombinierten die Forscher die Verfahren der Einzelzell-Analyse mit neuartigen örtlich aufgelösten Analysemethoden. Durch die Bestimmung des RNA-Gehalts einzelner Knochenmarkszellen identifizierte das Team 32 verschiedene Zelltypen, darunter extrem seltene und bisher unbekannte Arten von Zellen. „Wir vermuten, dass diese seltenen „Nischenzellen“ die einzigartige Mikro-Umgebung im Knochenmark schaffen, die für die Funktion der Stammzellen und die Produktion neuer Blut- und Immunzellen notwendig ist“, erklärt Simon Haas, Gruppenleiter am DKFZ und HI-STEM und einer der Initiatoren der Studie.
Mit einer innovativen Berechnungsmethode konnten die Forscher nicht nur die dreidimensionale Organisation der verschiedenen Zelltypen im Knochenmark bestimmen und damit einen „3D-Atlas des Knochenmarks“ erstellen, sondern auch deren zelluläre Wechselwirkungen und Kommunikation vorhersagen. „Wir können erstmalig die räumlichen Interaktionen in einem Gewebe auf der Grundlage genomischer Daten rechnerisch ableiten“, erklärt Lars Velten aus der Gruppe von Lars Steinmetz.
„Unser Datensatz ist für jedes Labor der Welt öffentlich zugänglich und könnte bei der Verfeinerung von In-vivo-Studien hilfreich sein“, sagt Lars Steinmetz, Gruppenleiter und Direktor der Life Science Alliance am EMBL Heidelberg. Die Daten, die bereits heute von verschiedenen Forschergruppen genutzt werden, sind über eine benutzerfreundliche Web-App weltweit zugänglich.
Mit den in dieser Arbeit beschriebenen Methoden kann prinzipiell die dreidimensionale Organisation jedes Organs auf Einzelzell-Ebene analysiert werden. „Unser Ansatz ist breit anwendbar und könnte auch zur Untersuchung der komplexen Pathologie menschlicher Erkrankungen wie Anämie oder Leukämie eingesetzt werden“, betont Andreas Trumpp, Geschäftsführer von HI-STEM und Abteilungsleiter am DKFZ.
Nachweis: Chiara Baccin, Jude Al-Sabah, Lars Velten, Patrick M. Helbling, Florian Grünschläger, Pablo Hernández-Malmierca, César Nombela-Arrieta, Lars M. Steinmetz, Andreas Trumpp, and Simon Haas: Combined single-cell and spatial transcriptomics reveal the molecular, cellular and spatial bone marrow niche organization. – Nature Cell Biology 2019, https://doi.org/10.1038/s41556-019‑0439‑6
Foto: Dreidimensionale Segmentierung einer Region des Knochenmarks. Verschiedene Nischenzellen (grüne und rote Punkte) und Blutgefäße (grau) sind hervorgehoben. Quelle: DKFZ, EMBL und Universitätsspital Zürich